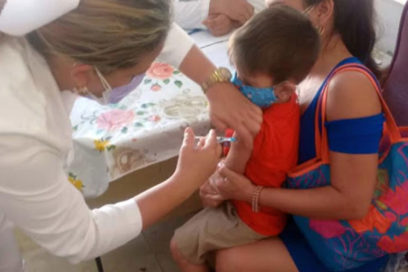
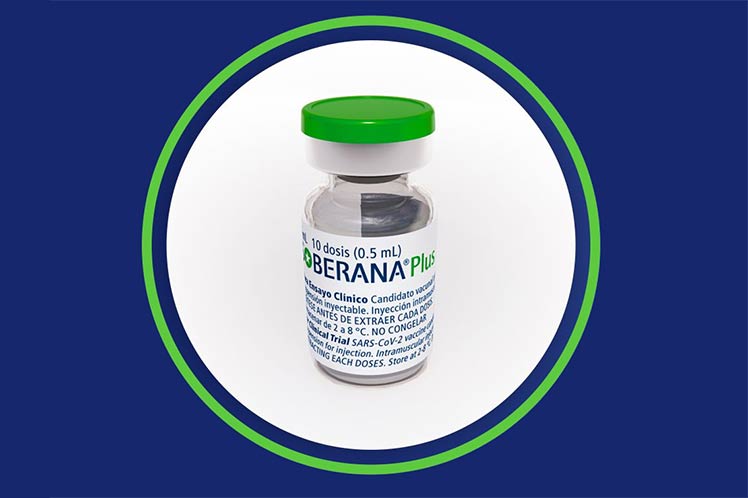
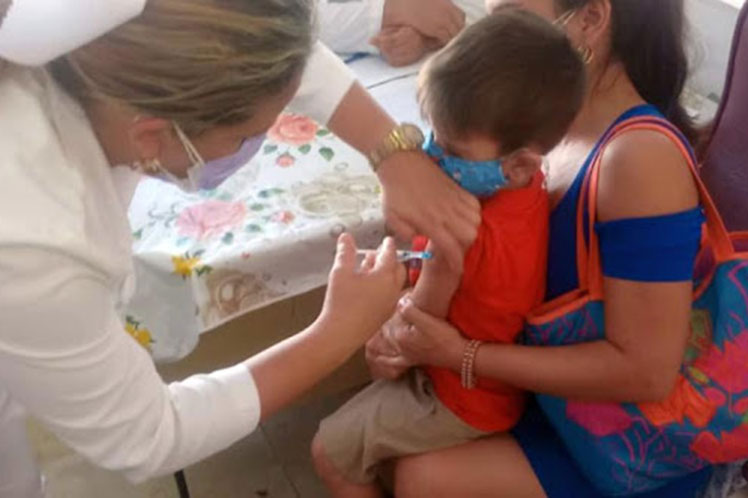
Especialistas del Instituto Finlay de Vacunas (IFV) y el Ministerio de Salud Pública ofrecieron hoy detalles sobre el ensayo clínico con la vacuna Soberana Plus en convalecientes de COVID-19 en edad pediátrica, denominado Soberana Plus Pediatría.
El ensayo constituye un estudio fase I/II abierto, adaptativo, para evaluar la seguridad, reactogenicidad y la inmunogenicidad de la formulación en ese grupo poblacional, y es posible gracias al autorizo de uso en emergencia del producto, emitido recientemente por el Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED).
La vacunación con este inmunógeno comenzará la próxima semana sin el uso de placebo, y comprenderá a 520 niños y adolescentes con dos meses o más de recuperados, que fueron diagnosticados con COVID-19 mediante prueba de PCR.
El reclutamiento comienza mañana en el Hospital Pediátrico Juan Manuel Márquez, de esta capital, a partir del registro de los convalecientes y el 5 de octubre comenzará la aplicación de la dosis única, con la participación de 40 individuos (20 de edades de 2 a 11 años y 20 de 11 a 18), divididos por igual en sintomáticos y asintomáticos, y con la inclusión de quienes sufrieron la enfermedad como leves, graves y críticos.
A ellos se les dará seguimiento en los primeros 60 minutos tras la inyección, y en 24, 48 y 72 horas posteriormente, además se evaluará su evolución al septimo día y se realizarán análisis de sangre de manera aleatorizada a los 14 y 28 días.
Luego en la fase II, reunidas las evidencias de seguridad clínica y con la aprobación del CECMED, intervendrán los 480 sujetos restantes, en el Juan Manuel Márquez y en el Hospital Pediátrico Universitario Paquito González Cueto, de Cienfuegos.
Durante la fase II el objetivo fundamental será analizar la inmunogenicidad y se prevé que a mediados de noviembre se tengan los resultados finales.
El doctor Rinaldo Puga Gómez, investigador principal del ensayo clínico, explicó a la prensa que los criterios de inclusión abarcarán la voluntariedad expresada mediante consentimiento informado, la aprobación de los padres o tutores legales, la valoración nutricional, exámenes físicos, resultados de laboratorio y el uso de métodos anticonceptivos (en el caso de las adolescentes en edad fértil).
Agregó que se excluirán quienes hayan recibido alguna dosis de candidatos vacunales o vacunas contra el SARS-CoV-2, hayan presentado enfermedad febril o infecciosa aguda en los siete días previos a la administración de la vacuna o en el momento de su aplicación, o tengan tratamiento con antimicrobianos o con medicamentos antiinflamatorios no esteroideos.
Tampoco podrán incluirse sujetos con enfermedades crónicas no transmisibles no controladas, con padecimientos del sistema inmune congénitos o adquiridos, con antecedentes de enfermedad neoplásica, con abuso de sustancias tóxicas durante los últimos 30 días o enfermedad adictiva a sustancias tóxicas, excepto el tabaquismo.
Otros criterios de exclusión se relacionan con facultades mentales disminuidas, alergias severas, participación en otro ensayo clínico de intervención preventiva o terapéutica en los últimos tres meses, la aplicación de otra vacuna, el tratamiento con inmunomoduladores, transfusiones de sangre o hemoderivados, embarazo, puerperio o lactancia o tatuajes en la región deltoidea de ambos brazos.
La composición de Soberana Plus consiste en dos moléculas de RBD (formato dimérico) adyuvadas en hidróxido de aluminio, misma formulación que se aplica en el esquema heteorólogo de Soberana 02 más Plus, y el producto que de manera independiente se emplea en la población adulta convaleciente de COVID-19.
(Tomado de ACN)